Elektrophysiologische Auswirkungen von genetischen Mutationen im menschlichen Herzen
- Forschungsthema:Elektrophysiologische Auswirkungen von genetischen Mutationen im menschlichen Herzen
- Typ:Diplomarbeit
- Betreuung:
- Bearbeitung:
Beschreibung
Erkrankungen des Herz-Kreislauf-Systems sind in Deutschland und anderen westlichen Industrienationen die häufigste Todesursache. Dazu zählt neben dem Herzinfarkt auch der plötzliche Herztod, der durch Kammerflimmern verursacht wird. Die Ursachen dafür sind noch nicht vollständig verstanden und sehr vielfältiger Natur. Darunter finden sich auch einige, die durch genetische Defekte hervorgerufen werden. Sie sind auf bestimmte Weise besonders ernst zu nehmen, da sie im Vorhinein – z. B. im EKG – kaum zu erkennen sind und ohne Warnung zum plötzlichen Tod führen. Die Durchführbarkeit experimenteller Untersuchungen und klinischer Studien an menschlichen Herzen ist sehr begrenzt. Die Eigenschaften veterinärer Herzen dagegen weichen oft bedeutend von denen der Menschen ab. Des Weiteren sind medizinische Beobachtungen hauptsächlich auf Oberflächenmessungen beschränkt, während Arrythmien dreidimensionale Phänomene darstellen. Man versucht daher, das menschliche Herz auf der Basis mathematischer Modelle mit Computern zu simulieren. Ein zentraler Bestandteil ist dabei die elektrophysiologische Beschreibung einer Zelle. Vor einem halben Jahrhundert haben Hodgkin und Huxley ein theoretisches Modell entwickelt, das die Erregbarkeit von Nervenzellen unter anderem anhand der Ionenströme durch die Zellmembran mithilfe von Ratengleichungen (Differenzialgleichungen 1. Ordnung) beschreibt. Bis heute dient es als Grundlage für viele Computermodelle, die die Eigenschaften menschlicher Herzmuskelzellen wiedergeben. Fortschritte bei den Messmethoden einerseits sowie einem besseren Verständnis der molekularen Grundlagen andererseits haben allerdings Grenzen dieser Modelle erkennen lassen. Es wurden andere Ansätze für die Beschreibung der Ströme durch Ionenkanäle gesucht; einer davon ist die Verwendung von Markov-Ketten. Das Konzept dieser Markov-Modelle ist es, sich so genau wie möglich der Struktur des kanalbildenden Proteins anzugleichen. Mutationen in Genen, die für Kanalproteine kodieren, sind gewissermaßen nicht nur die Ursache schwerer Krankheiten, sondern können heutzutage gezielt ausgelöst und dazu verwendet werden, um die Funktionalität verschiedener Strukturen dieser Kanalproteine zu erforschen.
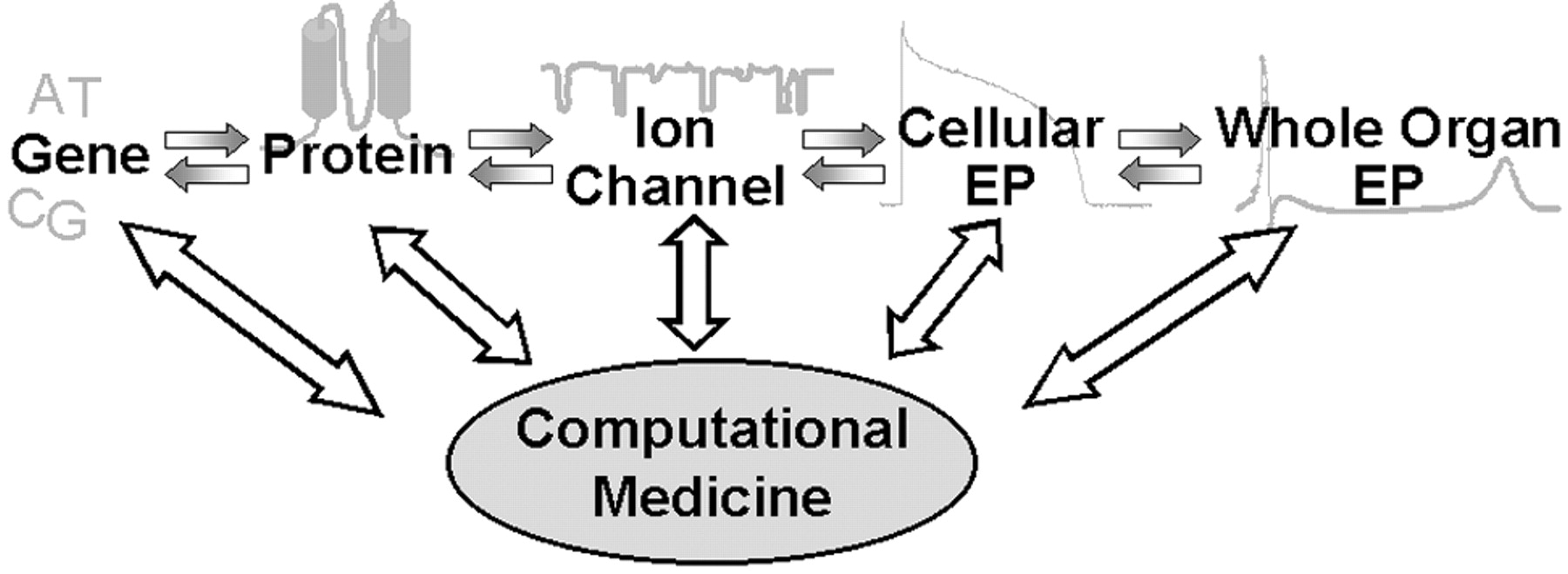
Schwerpunkte der Arbeit
Ziel dieser Arbeit ist es, die kinetischen Auswirkungen bestimmter Mutationen in einem Kaliumkanal des Herzens mithilfe eines Markov-Modells näher zu untersuchen. Die vorliegende Arbeit untergliedert sich in folgende Kapitel:
- In Kapitel 2 wird auf elektrophysiologische Grundlagen der Zelle eingegangen. Außerdem werden die Funktionsweise von Ionenkanälen einzeln und im Verbund erläutert.
- Kapitel 3 stellt zum einen das klassische Zellmodell von Hodgkin und Huxley und zum anderen darauf aufbauende Modelle für ventrikuläre Herzmuskelzellen vor.
- Kapitel 4 behandelt vergleichend dazu Markov-Ketten und darauf basierende Markov-Modelle für Ionenkanäle.
- In Kapitel 5 werden die untersuchten Mutationen und ihre kinetischen Auswirkungen vorgestellt sowie die Methode zur Bestimmung eines bestmöglichen Parametersatzes.
- Das darauffolgende Kapitel 6 präsentiert schließlich die erzielten Ergebnisse.
- Im Anhang finden sich Übersichten über verschiedene Kanalproteine samt Nukleotidbasen-und Aminosäuresequenzen. Außerdem ein Vergleich zwischen Hodgkin-Huxley und Markov-Beschreibung eines Ionenkanals.

